
一、医疗器械产品怎么办理CE认证MDR指令? 2017年5月,欧盟医疗器械新法规MDR(REGULATIONEU2017/745)颁布,新的法规将替代原有的医疗器械指令(MDD93/42/EEC)和有源植入性医疗器械指令(AIMDD90/3..
138-2432-8299 立即咨询 扫码咨询
扫码咨询
发布时间:2020-12-28 热度:
一、医疗器械产品怎么办理CE认证MDR指令?
2017年5月,欧盟医疗器械新法规MDR(REGULATIONEU2017/745)颁布,新的法规将替代原有的医疗器械指令(MDD93/42/EEC)和有源植入性医疗器械指令(AIMDD90/385/EEC)。依据MDRArticle123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
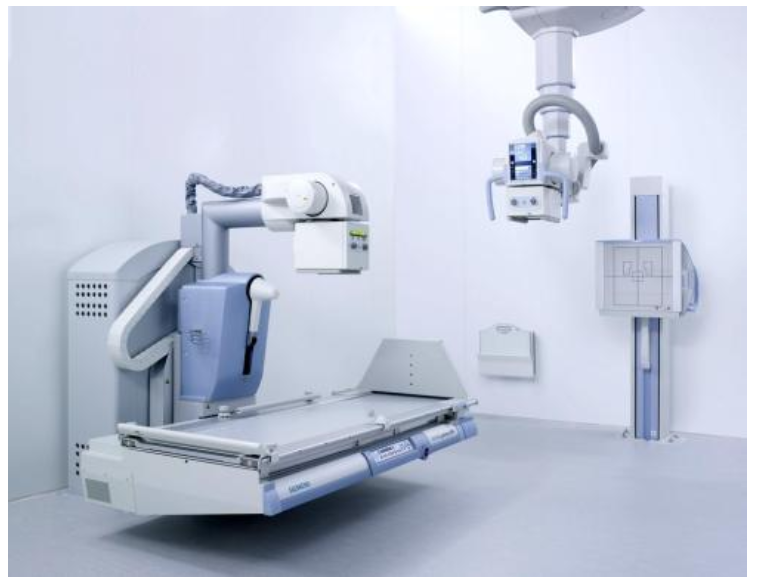
二、CE认证MDR指令的主要变化:
1、强化制造商的责任:指定合规负责人/持续更新技术文件/财务保障。
1)咨询应确保指导企业确定合适的人选,协助确定合规负责人的职责。
2)同时要确保合规负责人有相应的能力、资质和经验来承担相应的职责。
3)履行职责需要提供证据表明。
2、更严格的上市前评审:部分产品的分类变高/加强对临床证据的要求/对特定高风险器械将采用上市前审查机制,由欧盟级别的专家组参与,进行更严格的事先评估。
1)所有的医疗器械都需要依据新的MDR法规重新判定分类。有可能是:
器械分类变化
分类规则变化
依据法规的变化
2)所有的医疗器械都需要依据新的MDR法规重新进行基本要求检查,形成基本要求检查表。
3)技术文件的结构需要进行调整,分为两大部分,分别是:产品技术文件和上市后技术文件。
注:特别关注:
设计信息需要纳入技术文件;
风险分析关注风险和收益的比较;
临床前评价包括所有的欧盟协调标准的检测带来的符合性证据;
临床评价需要按照Rev4;
上市后需要系统的方法进行策划。
4)关注可重复使用的器械,原属于ClassI的器械,按照新法规变成了ClassI*类器械。
3、适用范围扩大:非医疗用途,但其功能和风险特征与医疗器械相似的器械将同样纳入MDR的管理范围。
4、提高透明度和可追溯性:使用唯一器械标识(UDI)系统识别和追踪器械/患者将收到具有所有基本信息的植入卡/将建立包含器械认证信息和临床研究、警戒和上市后监测信息的修订后的可公开访问的EUDAMED数据库。
5、加强警戒和市场监管:一旦器械可以在市场上使用,制造商将必须收集有关其性能的数据,欧盟国家将在市场监管领域进行更密切的协调。
三、医疗器械办理CE认证MDR指令流程:
1、项目申请——向亿博检测监管递交CE认证申请表。
2、资料准备——根据CE认证要求,企业准备好相关的认证文件。
3、产品测试——企业将待测样品寄到实验室进行测试。
4、编制报告——认证工程师根据合格的检测数据,编写报告。
5、递交审核——工程师将完整的报告进行审核。
6、签发证书——报告审核无误后,颁发CE认证证书。
我司亿博检测专业提供机械CE认证代理咨询服务,进一步了解可详见文章:《危险机械CE认证办理流程是什么》

医疗企业都知道,部分医疗器械产品出口欧洲需要进行CE认证办理。这是一项市场准入原则。亿博是医疗认证机构,欢迎咨询。欧盟为消除各成员国间的贸易壁垒,逐步建立成为...

CE认证费用主要取决于认证的产品、选择的认证机构和产品的相关指令。不同的产品测试项目也截然不同,一般常见产品为电子电器类产品,常见测试项目分类EMC与LVD指令。而医...
CE认证简介 CE认证是一种安全认证标志,是产品进入欧盟境内销售的通行证。在欧盟市场CE认证属强制性认证标志。CE由法语CommunateEuroppene缩写而成,是欧洲共同体的意思。欧洲共...
CE认证是一个完善的安全保障系统,并非仅仅是一个样品拿到试验室检验通过而已。一个通过CE认证的产品必须确保自产品的设计、生产、包装、说明书到运输、销售等产品的整个...

官方微信公众号
深圳市宝安82区新安六路勤业商务中心A栋一楼112-114
邮箱:yuhaoqun@ebotek.cn
微信:13824328299(同手机号码)